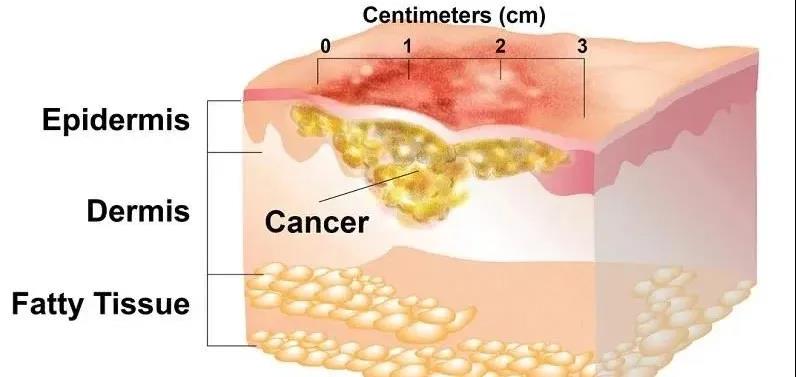
圣诺制药于今天公布:其首选核酸干扰创新药STP705在目前进行的治疗皮肤原位鳞状细胞癌(squamous cellcarcinoma in situ,isSCC)二期临床试验的中期分析报告中显示顶线阳临床数据。
圣诺制药是一家致力于发现和开发针对癌症和纤维疾病的核酸干扰(RNAi)药物国际领先企业。该公司今天宣布,其正在进行的临床IIa期研究的核酸干扰创新药STP705,在治疗非黑色素瘤性皮肤癌,专门针对原位鳞状细胞癌试验的中期分析报告中显示明确的有效性和安全性结果。在对前三个剂量组的的研究结果分析表明:大部分受试者在接受STP705药物治疗后,可观察到原位皮肤鳞状细胞癌的彻底组织学清除,达到了临床试验的主要终点。
这项开放标签、剂量递增的临床研究旨在评估不同剂量的STP705通过皮肤原位鳞状细胞癌肿瘤病灶中注射给药的安全性、耐受性和疗效。该试验由5个剂量递增组,剂量从10μg到120μg,每组5名患者,总共25名患者将被纳入本项试验。受试患者须每周给药一次,持续6周。中期分析报告包括前三组接受10μg、20μg和30μg用药剂量水平治疗效果。中期分析获取样本数据的截止日期为2020年3月2日。
本试验的主要终点是评价患者在接受治疗后的皮肤原位鳞状细胞癌肿瘤病变是否完全的组织学清除。根据前三组试验结果的中期分析报告,66%的患者(10/15)获得了完全的组织学清除。10微克和20微克治疗组均有3例(60%,3/5)达到组织学清除,而30微克治疗组有4例(80.0%,4/5)达到完全的组织学清除,且呈剂量依赖性。
STP705在关键的次要终点的安全性评估上显示出良好结果。研究中没有出现与试验药物治疗相关的不良事件,也没有严重的不良事件报告。特别重要的是,治疗组没有发现明显的局部皮肤反应。目前,另外两个更高剂量组(60微克和120微克)的临床试验正在推进,并希望通过这两组试验确认最佳的治疗剂量窗口。
圣诺制药总裁兼首席执行官陆阳博士指出: “我们首个核酸干扰创新药,在肿瘤学临床研究中期分析的结果令人振奋,也是我们多年来创新创业的重要里程碑。尤其是试验中大部分患者在用药治疗后,达到主要终点并呈现剂量依赖性的效果,不仅显示了核酸干扰(RNAi)疗法在肿瘤治疗中的巨大潜力,而且也验证了多肽纳米制剂用于小干扰核酸(siRNA)药物导入技术的安全性和有效性。本次试验的顶线治疗效果进一步验证了TGF-β1作为肿瘤治疗靶点的重要性,以及圣诺制药双靶点核酸干扰研发策略在肿瘤治疗领域的成功。” 陆阳博士强调:”这项临床研究中期分析报告中所展示的这些疗效和安全性结果,进一步奠定了我们在核酸干扰药物癌症治疗领域的国际领先地位。”
圣诺制药首席医学官Michael Molyneaux医学博士说:“这项研究中期分析报告的结果非常令人鼓舞,因为我们达到并且验证了高比例肿瘤病灶组织清除率是皮肤癌治疗的金标准。同时获得了疗效与安全性之间良好的结合。最重要的是,试验表明没有局部皮肤反应,这对患者和临床医生至关重要,因为这一治疗手段为替代手术切除病变的传统方法提供了安全有效的选项。”
美国迈阿密大学医学院教授,临床和美容研究中心主任,本项临床研究的负责人Mark Nestor医学及科学博士指出“原位鳞状细胞癌目前的治疗标准是手术切除,或者破坏,或者放射治疗。而通过一种非手术、无疤痕,注射治疗手段同时对病患更为有益的选择,将改变那些非黑素瘤皮肤癌治疗的传统观念和模式。“
关于非黑色素瘤皮肤癌(NMSC)和原位鳞状细胞癌(isSCC)
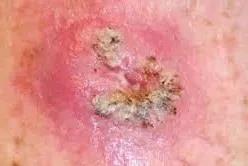
原位鳞状细胞癌,又称鲍恩病,是鳞状细胞皮肤癌(SCC)的最早形式。鳞癌与基底细胞癌是非黑色素瘤性皮肤癌的两个主要亚型之一。鳞状细胞癌的发生与影响鳞状细胞谱系承诺和终末分化的基因组微扰、基因突变和关键分子表达改变(如TGF-β1和COX-2的过度表达)密切相关。鳞状细胞癌最常见的发生部位是面部、颈部、秃头、前臂伸肌、手背和胫骨。目前手术是治疗非黑色素瘤的传统治疗方法。单纯手术切除成功率低,复发率高30%, 而且各种形式的手术方式都会带来严重的皮肤不良事件、疤痕、感染和出血的风险。应注意的是,由于疤痕、出血、与手术相关的感染风险以及相关的附带考虑/成本,注射用药治疗的安全有效行比手术治疗更可取。
有关本临床试验的更多信息,请访问网址:clinicaltrials.gov,临床试验号为:NCT04293679。
关于STP705:
圣诺制药领先的候选产品STP705是一种siRNA(小干扰RNA)治疗药物,它利用双重靶向抑制特性和多肽纳米粒(Peptide-Nano particle,PNP)增强小干扰核酸的体内导入,直接降低TGF-β1和COX-2基因的表达。该候选产品已获得美国FDA和中国NMPA的多项IND批准,包括胆管癌、非黑色素瘤皮肤癌和增生性瘢痕的治疗。STP705还获得治疗胆管癌和原发性硬化性胆管炎的孤儿药认证。使用STP705的临床前动物模型已经证明,在单药作用下,T细胞在肝脏肿瘤中的渗透性显著改善,并且抗PD-L1抗体检查点抑制剂在HCC模型中的疗效也有改善。除了针对PD-1/PD-L1轴的作用外,这种作用还可能提高其他免疫检查点抑制剂的作用。

关于圣诺制药:
圣诺制药是一家注册于美国特拉华州、总部位于美国马里兰州、在中国苏州和广州设有分公司的核酸新药创制的领军企业。公司的使命是开发创新疗法,减轻病患痛苦,增进人类健康,并在高未满足医疗需求领域推进患者护理。公司的宗旨是:创新引领,全球视野,病患第一。高层管理团队的成员在美国和中国的生物制药行业、金融、临床和商业管理方面有着丰富的综合经验。该公司的资金来自机构投资者、企业合作伙伴和基金支持。圣诺制药拥有国际领先的核酸药物导入技术和新药创制及产业化平台,并具有坚实的知识产权组合和丰富的产品线。重点治疗领域包括肿瘤和纤维化疾病的治疗。
