Sparx全球首个claudin18.2/PD-L1双特异抗体临床前数据发布
07-01,2020
近日,总部位于美国芝加哥的Sparx Therapeutics公司在AACR-2020年会上首次公布了其抗蜜蛋白18剪切变体2(claudin18.2或者CLDN18.2)抗体(Abstract#3361)和CLDN18.2/PD-L1双特异抗体(Abstract# 534)的临床前结果。后者是目前为止全球首个抗CLDN 18.2/PD-L1双特异抗体。该研究由Sparx Therapeutics公司和北京大学肿瘤医院寿成超教授课题组合作开展。
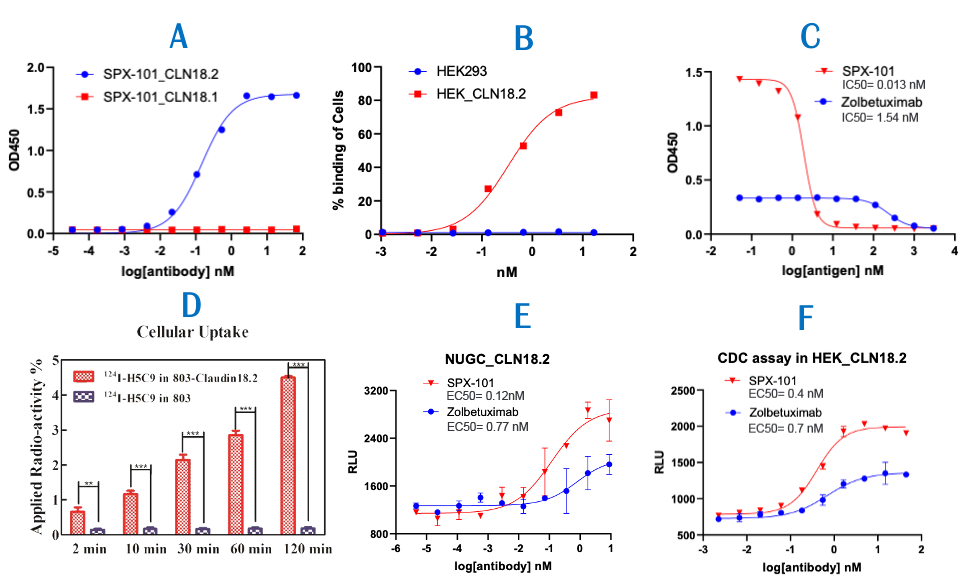
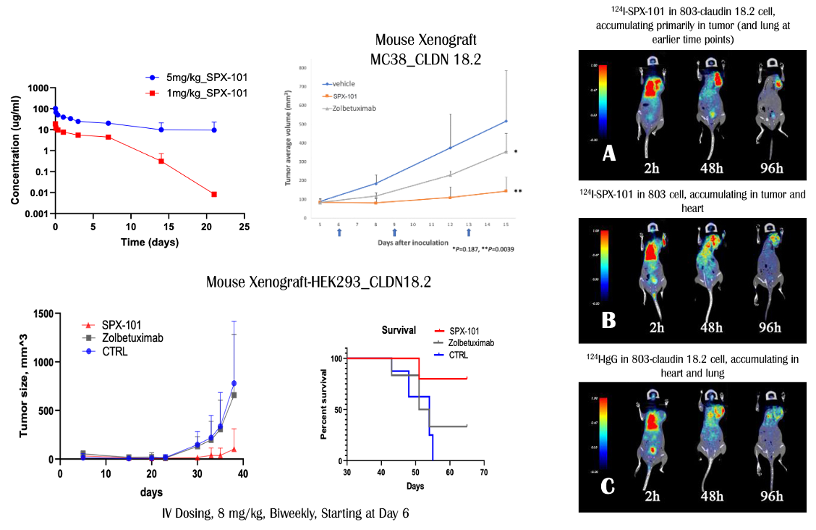
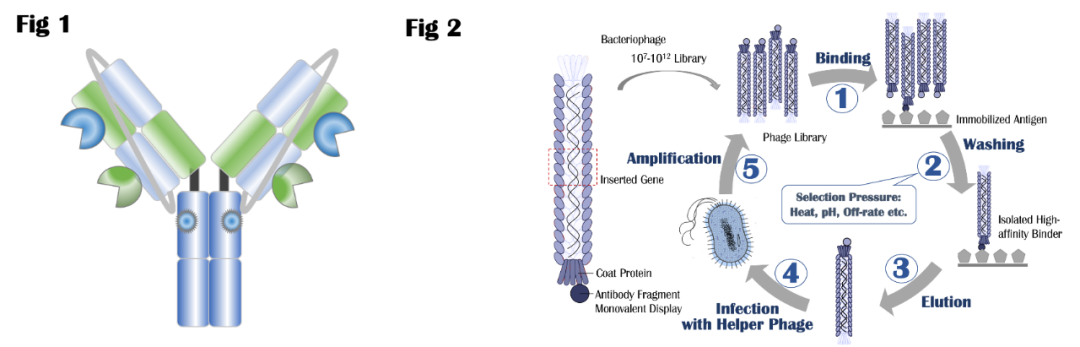
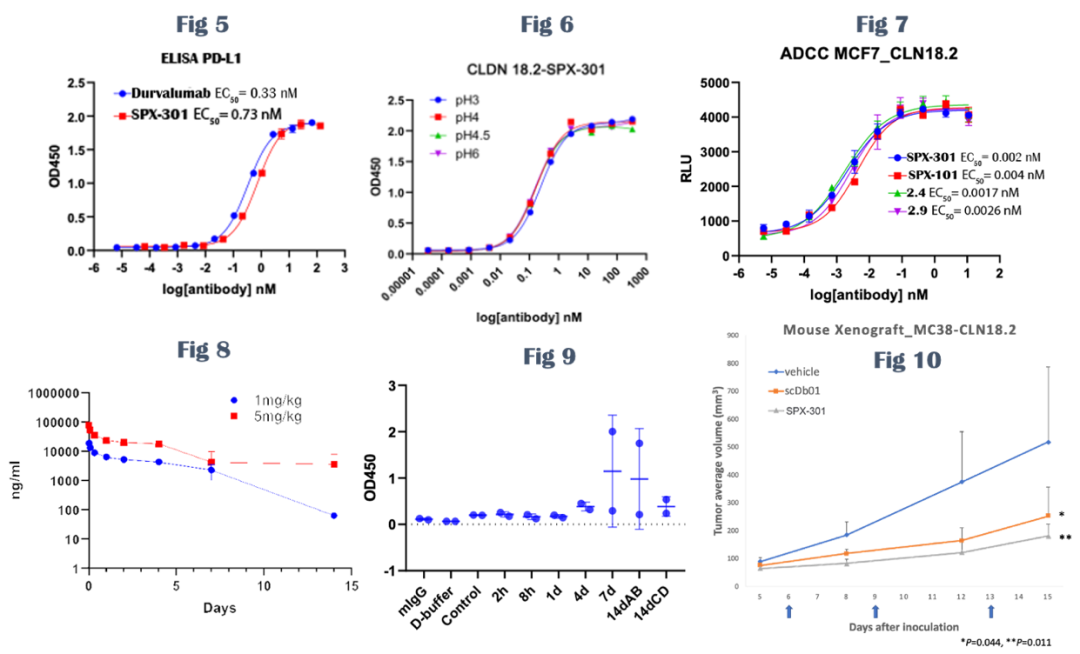
如图1所示,Claudin 18(CLDN18)是一种由CLDN 18基因编码的蛋白质,属于细胞紧密连接蛋白家族(Tight JunctionProteins),可以控制层细胞之间的分子流动。CLDN 18具有两个剪接变体,分别为CLDN 18.1和CLDN 18.2。二者同源性极高、只有八个氨基酸的序列差异。CLDN 18.2蛋白是一种CD20样分化蛋白,在多种肿瘤组织中高度表达,比如胃癌(60-80%)、胰腺癌(50%)、食管癌(30-50%)和肺癌(40-60%)等,但是在正常组织中几乎没有表达。相反,CLDN 18.1在正常肺的细胞中选择性表达。所以特异性地抑制CLDN 18.2被一致认为是治疗晚期或者转移性胃癌的一个有效途径。自德国Ganymed公司在ASCO2016年会上公布了其抗CLDN 18.2嵌合抗体zolbetuximab的FAST临床试验结果后,CLDN 18.2作为一个崭新抗癌分子靶点引起业界广泛关注,直接导致当年被安斯泰来以16亿美元收购。胃癌在全球癌症死亡中位列第三、是一种难治性肿瘤,且可选择的靶向药物较少、疗效欠佳。胃癌5年生存率大约只有5%-20%,晚期胃癌患者的中位总生存期(OS)约为10个月。朱贵东博士在Abstract#3361中报道了Sparx制药公司的抗CLDN 18.2单克隆抗体候选药SPX-101的发现过程和分子特征。他们采用小鼠杂交瘤技术,通过多种免疫方法获得了一系列高活性、高选择性的抗CLDN 18.2鼠源抗体。之后通过序列比对和人源化,获得人源化的抗CLDN 18.2先导抗体。为了进一步优化候选抗体,Sparx公司又通过噬菌体展示筛选技术对先导抗体进行成熟化,全面的药理、药动、以及安全性评价获得其候选抗CLDN 18.2候选抗体SPX-101。头对头实验表明,SPX-101对CLDN 18.2的亲和力比zolbetuximab高100余倍(0.013nM相比1.54 nM,图C),对CLDN 18.1游离蛋白或者细胞表面蛋白的选择性都超过4000倍(图A/B)。I124同位素标记实验表明,SPX-101对胃癌803细胞的摄入和CLDN18.2的表达水平成正相关。除此之外,SPX-101还有结合力对酸、温度不敏感等优点,而且细胞功能性实验、动物肿瘤模型均显示优于安斯泰来同类药物zolbetuximab的活性,展现同类最佳潜力。上图是SPX-101的一部分动物实验结果。同位素标记实验指出,I124-SPX-101能有效地在稳定表达CLDN 18.2的胃癌组织中富集,但对不表达CLDN 18.2的野生型803胃癌或者同位素标记的免疫球蛋白G则没有观察到相同现象(右)。SPX-101在小鼠和大鼠内的药物动力学特征也比较理想,不仅半衰期比较长、而且抗药抗体(ADA)水平比较低,免疫原性较低预测安全性可能很好(左上)。小鼠接种模型显示,SPX-101在至少两个种肿瘤模型中都表现良好的肿瘤抑制疗效(p=0.0018),并且头对头比较疗效优于安斯泰来的zolbetuximab(左)。Abstract# 534描述了Sparx制药公司的抗CLDN 18.2/PD-L1双特异抗体候选药SPX-301的设计、筛选和评价过程。CLDN 18.2主要在胃癌表达、而PD-1药物在胃癌的疗效与化疗比优势微弱,所以借助CLDN 18.2对胃癌优异的选择性增加PD-1药物活性和应答人群是个比较理想的开发策略。SPX-301采用了Sparx自主知识产权的SMARTOPTM模式构建,并且利用其LEMMAbTM噬菌体展示技术分段优化。这类新型双抗构建模式除了具有表达量高、无错配、高水溶性、高稳定性等优势外还强调对耐酸性和低解离速率的优化。SPX-301与CLDN 18.2、PD-L1结合力、免疫原性、和聚合性都与单抗类似,但在细胞实验中显示优于单抗的功能活性(下图)。动物实验结果表明,SPX-301具有和单克隆抗体类似的药物动力学特征(下左),对小鼠的抗药抗体(ADA)水平也很低,所以可能免疫原性较低、安全性良好(下中)。小鼠接种实验表明,SPX-301能有效地抑制稳定表达CLDN 18.2的MC38肿瘤生长,且具有统计学显著(p=0.01)。据报告人朱贵东博士指出,目前Sparx公司已经开始了SPX-301的中试和安全性评价,建立了SPX-301的稳定细胞系,且收率和单克隆抗体相仿。根据公开数据库信息,SPX-301是目前全球首次披露的进入中试阶段的抗CLDN 18.2/PD-L1双特异抗体。朱贵东博士还透露,为了精准筛选入组患者、提高临床试验的成功率,Sparx公司还开发了针对CLDN 18.2的免疫组化伴随检测试剂盒(CDx)SPX-102。采用该CDx,他们对456个亚裔胃癌样本进行了检测,结果发现43%的胃癌样本呈现CLDN 18.2阳性。对其中的328例胃癌患者组织切片分析显示,SPX-102阳性水平和患者预后呈负相关,所以SPX-102伴随检验试剂盒也有望成为预测胃癌患者预后的一个有效手段。AACR会后,笔者对Sparx公司创始人朱贵东博士做了一个简单采访。朱博士指出具有治疗价值的实体瘤抗原非常少见,CLDN 18.2是个珍贵礼物。如何利用双抗、ADC、Fc重塑等抗体技术实现每个抗原的最大治疗价值也是一个非常复杂的工作。赫赛汀上市20多年后更优质靶向HER2的ADC如Enhertu才刚刚上市,双抗如ZW25刚刚开始关键临床,我们有信心把CLDN 18.2打造成下一个HER2。Sparx不仅发明了SMARTOPTM和LEMMAbTM等相关支持技术,在Fc改造和定点ADC等方向也有部署。我们期待这些药物能早日在临床试验中展现治疗价值,解除胃癌这个东亚主要肿瘤给患者带来的威胁和痛苦。Sparx成立于2018年,除了CLDN18.2研发管线中还有靶向其它实体瘤全新靶点的抗体和小分子药物。